【錯誤】網傳「特好消息!新冠疫情再見了…美國即將有治療新冠病毒的口服液…患有新冠狀病毒者在家口服該藥5天,體內徹底清除了新冠狀病毒」?
【錯誤】網傳「特好消息!新冠疫情再見了…美國即將有治療新冠病毒的口服液…患有新冠狀病毒者在家口服該藥5天,體內徹底清除了新冠狀病毒」?
【報告將隨時更新 2022/2/5版】
一、 美國默克藥廠(在台灣稱美商默沙東)和生技公司Ridgeback Biotherapeutics 正在研發用於治療新冠肺炎的藥物莫納皮拉韋(Molnupiravir),進度落在第二期至第三期合併臨床試驗,尚未有最終臨床結果。(更新:中央流行疫情指揮中心在2022年1月24日宣布,向美商默沙東公司採購之COVID-19口服抗病毒藥Molnupiravir已運抵台灣,並納入新冠病毒感染臨床處置暫行指引,提供具有重症風險的輕中度患者使用。根據藥廠在2021年10月1日發佈的新聞資料,莫納皮拉韋第三期臨床試驗期中分析顯示,可降低輕度或中度COVID-19患者住院或死亡風險。)
二、莫納皮拉韋(Molnupiravir)為口服抗病毒藥物,並非傳言所稱的口服液。
三、專家指出,新藥臨床療效評估須經過第三期臨床試驗驗證其治療效益,並藉由發表於科學期刊過程中嚴謹的同儕審查,驗證其研究執行以及評估的正確性,才可採信其療效。
四、此報告是針對2021年4月流傳到9月份期間,宣稱美國將有治療新冠病毒的口服液。傳言流傳期間,莫納皮拉韋尚未公布第三期臨床試驗結果,傳言誇大宣稱療效及藥物上市時間,因此為「錯誤」訊息。
【更新說明 2022/2/5】因應台灣核准莫納皮拉韋緊急授權並進口,查核報告更新摘要一和爭議點二。
【更新說明 2021/10/4】因應藥廠公布莫納皮拉韋最新臨床試驗結果,查核報告更新摘要一、摘要四和爭議點二。
背景
社群及通訊平台近日流傳一則訊息,指出「特好消息! 新冠疫情再見了!(永遠不再見了) 美國即將有『治療新冠病毒的口服液』」。
傳言內容指出:
「患有新冠狀病毒者在家口服該藥5天,體內徹底清除了新冠狀病毒,患者徹底康復。 該葯譯名為「莫那皮納偉」(Monapinavir),由美「瑞吉貝爾」(Ridgeback) 和美國「默克」(Merck) 兩大藥廠聯合研製,已經在人體成功完成第一期和第二期臨床試驗,效果100%; 目前第三期臨床試驗接近收尾,效果非常好。 如果順利的話,在4~5個月內就可以面市。 該藥患者在家裡可以自己口服,5天痊癒,使用非常方便。 以後治新冠病毒就像現在治療普通感冒一樣。 新冠狀病毒就不可怕了……」
傳言所稱的「莫那皮納偉」,為中國用語,台灣譯文為「莫納皮拉韋」。
此訊息亦有以中、英文版本。
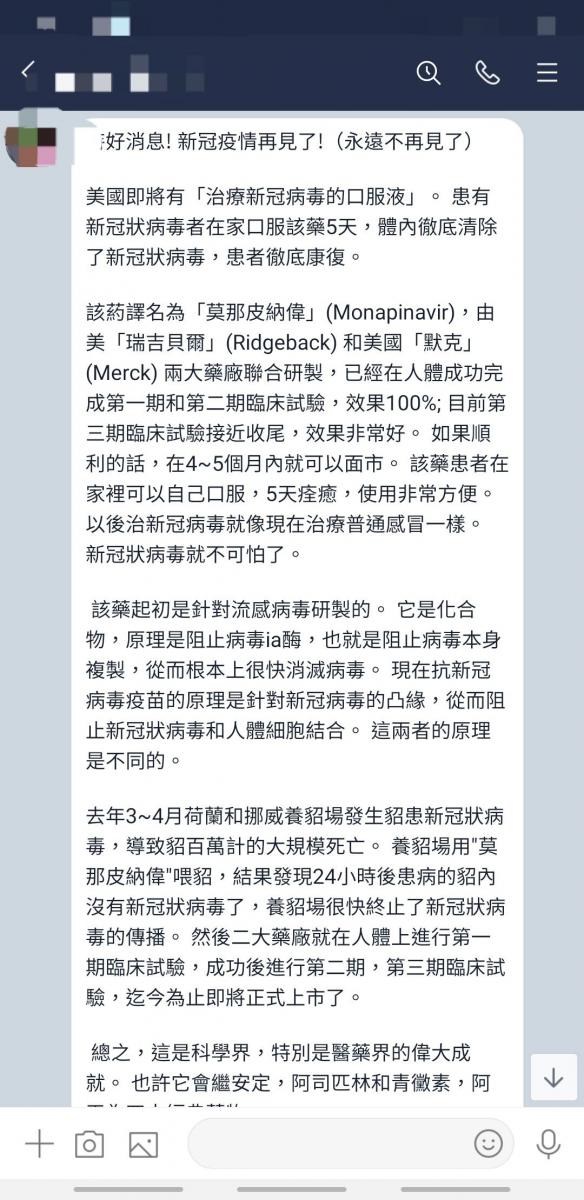
圖1:通訊軟體貼文擷圖
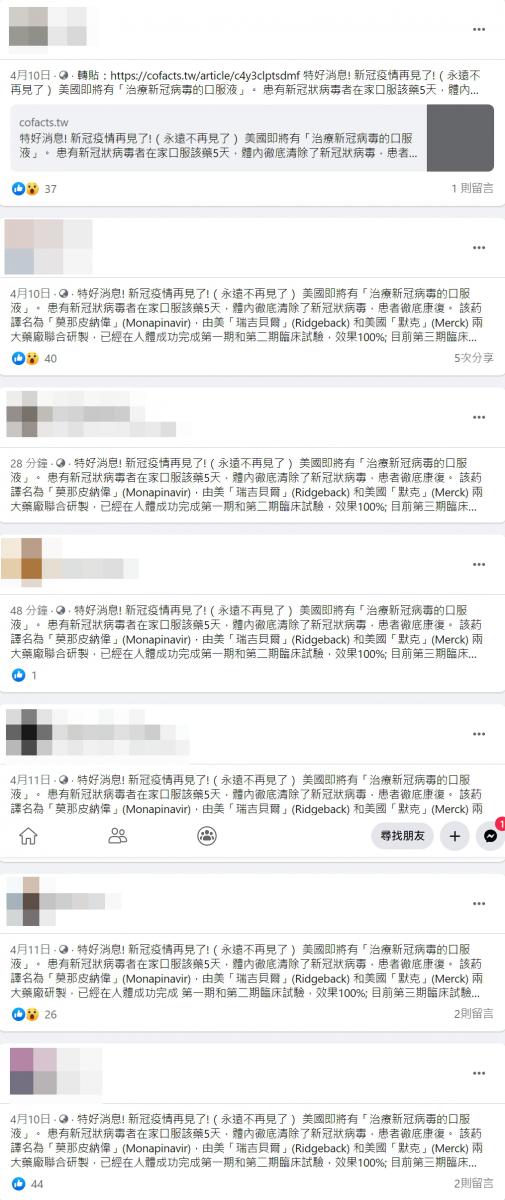
圖2:社群平台相關貼文擷圖
查核
爭議點一、網傳美國將有「治療新冠病毒的口服液」,該藥名為「莫那皮納偉」(Monapinavir)是否屬實?
(一)查核中心採訪中央研究院、國家衛生研究院博士謝興邦,謝興邦表示,確實有美國默克藥廠和生技公司Ridgeback Biotherapeutics 正在研發「莫納皮拉韋(Molnupiravir)」,應用於新冠肺炎病患治療的臨床試驗。
(二)查核中心進一步檢視美國默克(Merck)藥廠官網,其在今年美國時間3月6日上午12時發佈新聞宣布,默克與Ridgeback Biotherapeutics合作研發的Molnupiravir初步研究成果。美國默克為 Merck & Co., Inc. (Merck),在美國及加拿大以外的地區以默沙東藥廠 (Merck Sharp & Dohme,MSD) 為名。
查核中心比對,真實的藥名為Molnupiravir,傳言所稱的藥物名為Monapinavir並不正確。而此藥名在台灣翻譯為「莫納皮拉韋」。
(三)謝興邦說,莫納皮拉韋的藥物機轉是核苷衍生物,該藥物使用欺敵戰術,在病毒RNA複製過程中,引入複製錯誤來發揮其抗病毒作用。此外,傳言宣稱莫納皮拉韋是口服液,可能是翻譯的錯誤,該藥物不是液體,而是錠劑或膠囊的口服藥物。
查核中心詢問美商默沙東藥廠,藥廠表示,Molnupiravir為口服抗病毒藥物,並非口服液體。
爭議點二、莫納皮拉韋(Molnupiravir)目前研發進度為何?
(一)謝興邦表示,根據目前已知資訊,該藥物的臨床試驗進行到臨床2A。一般正規的藥物臨床試驗是做完2A後還要進行2B,之後再進入臨床3期。從目前藥廠提供的公開資料,該藥物正在進行臨床2及3期的合併實驗,預計收案3000人,但目前為止只完成202人的收案。
謝興邦說,因為目前的資料臨床試驗僅完成202人,且只是臨床2A的結果,沒有傳言所稱已做完臨床2期,也並非處在第3期收尾狀態,更沒有後續所稱「未來4到5個月就會面世」。該傳言宣稱該藥物「已經在人體成功完成第一期和第二期臨床試驗,效果100%; 目前第三期臨床試驗接近收尾,效果非常好」,這些都是錯誤的訊息。
(二)美商默沙東藥廠指出,Molnupiravir正在進行第2、3期的合併臨床試驗。根據臨床前的試驗研究已證實Molnupiravir能對抗引起COVID-19的病毒。但臨床試驗正在進行中,相關成效數據須待試驗結果發表,主要臨床結果預定於2021年間發布。
(三)美商默沙東藥廠在2021年10月1日發佈新聞稿指出,口服抗病毒藥物Molnupiravir第三期臨床試驗期中分析顯示,Molnupiravir與安慰劑相比,可減少輕度或中度COVID-19患者住院或死亡風險。藥廠將依據臨床試驗結果盡快向美國食藥署申請緊急授權。
(四)查核中心檢視,Molnupiravir在2021年底獲美國FDA緊急授權使用,根據台灣衛福部新聞稿,Molnupiravir的療效及安全性已有部分證據支持,美國FDA及國際間已陸續發布緊急使用授權(EUA)核准於臨床使用,以治療輕度至中度SARS-CoV-2感染且有重症危險因子的高風險患者,降低個案轉為重症需住院之風險,衛福部食藥署亦於2022年1月13日同意依據藥事法第48條之2規定,核准其專案輸入。首批2016人份的療程用藥也在2022年1月24日運抵台灣。
爭議點三、傳言宣稱:「有新冠狀病毒者在家口服該藥5天,體內徹底清除了新冠狀病毒,患者徹底康復」是否屬實?
(一)謝興邦表示,根據目前在202位病人身上完成的試驗結果,在服用藥物5天,給藥組可降低病人體內的病毒濃度;而控制組給予安慰劑,則有24%病患仍可在鼻腔中驗到新冠病毒。針對此傳言的內容,的確有Molnupiravir的臨床研究進行中,但臨床試驗的詳細結果還沒有公布,無法推論為「口服該藥5天,體內徹底清除了新冠狀病毒,患者徹底康復」。
(二)台大公共衛生學院教授陳秀熙表示,目前有多種宣稱可治療新冠病毒的藥物正在進行臨床試驗,也宣稱實驗效果很好。但如同所有運用於臨床治療的藥物一般,對於新冠肺炎治療藥物的臨床療效評估,也須經過第3期臨床試驗驗證其治療效益,並藉由發表於科學期刊過程中嚴謹的同儕審查,驗證其研究執行以及評估的正確性,才可採信其療效。完成第3期臨床試驗的藥物才可進一步送審各國的藥物食品管理單位,確保其臨床運用的程序完備與合宜。
陳秀熙說,目前於權威期刊發表的證據顯示,治療新冠肺炎的藥物在科學評估中,類固醇的臨床療效實證基礎較為可信,歐洲以及美國的治療準則皆依據此科學評估結果將其納入於臨床標準治療中。另外,早期曾受關注的抗病毒藥物瑞德西韋(Remdesivir),最近有較多的科學證據顯示,瑞德西韋可降低輕症感染者進展為重症的風險。
陳秀熙認為,在新冠肺炎變種病毒於世界各國快速擴散的威脅下,目前對於新冠肺炎治療或預防性藥物的研發也將遭遇挑戰。因目前的科學研究已顯示,先前曾感染新冠病毒康復者都不能在變種病毒的侵襲下完全免疫,現行的藥物要克服具有高感染力的變種病毒侵襲達到預防與治療的效果將更為困難。傳言所指的新藥如何迎戰變種病毒有非常大的疑問,需要科學的評估提供實證證據,傳言過於誇大。
結論
【報告將隨時更新 2022/2/5版】
一、 美國默克藥廠(在台灣稱美商默沙東)和生技公司Ridgeback Biotherapeutics 正在研發用於治療新冠肺炎的藥物莫納皮拉韋(Molnupiravir),進度落在第二期至第三期合併臨床試驗,尚未有最終臨床結果。(更新:中央流行疫情指揮中心在2022年1月24日宣布,向美商默沙東公司採購之COVID-19口服抗病毒藥Molnupiravir已運抵台灣,並納入新冠病毒感染臨床處置暫行指引,提供具有重症風險的輕中度患者使用。根據藥廠在2021年10月1日發佈的新聞資料,莫納皮拉韋第三期臨床試驗期中分析顯示,可降低輕度或中度COVID-19患者住院或死亡風險。)
二、莫納皮拉韋(Molnupiravir)為口服抗病毒藥物,並非傳言所稱的口服液。
三、專家指出,新藥臨床療效評估須經過第三期臨床試驗驗證其治療效益,並藉由發表於科學期刊過程中嚴謹的同儕審查,驗證其研究執行以及評估的正確性,才可採信其療效。
四、此報告是針對2021年4月流傳到9月份期間,宣稱美國將有治療新冠病毒的口服液。傳言流傳期間,莫納皮拉韋尚未公布第三期臨床試驗結果,傳言誇大宣稱療效及藥物上市時間,因此為「錯誤」訊息。
【更新說明 2022/2/5】因應台灣核准莫納皮拉韋緊急授權並進口,查核報告更新摘要一和爭議點二。
【更新說明 2021/10/4】因應藥廠公布莫納皮拉韋最新臨床試驗結果,查核報告更新摘要一、摘要四和爭議點二。










